 Le méthylphénidate (MPH) est la molécule la plus couramment utilisée dans le traitement du trouble déficit attentionnel et/ou de l’hyperactivité (TDAH) de l’enfant. Le MPH est un dérivé amphétaminique et de ce fait soulève des risques de mésusage ainsi de sécurité à long terme. Par ailleurs, le mécanisme d’action exacte du méthylphénidate n’est pas encore parfaitement connu. Dans cet article de synthèse paru dans la prestigieuse revue Trends in Pharmacological Sciences, le Professeur en neuropharmacologie Luc ZIMMER, directeur du CERMEP-Imagerie du Vivant (plateforme d’imagerie préclinique et clinique sur le site du Groupement Hospitalier Est à Lyon), nous présente un état des lieux sur l’apport des données de neuro-imagerie sur le MPH.
Le méthylphénidate (MPH) est la molécule la plus couramment utilisée dans le traitement du trouble déficit attentionnel et/ou de l’hyperactivité (TDAH) de l’enfant. Le MPH est un dérivé amphétaminique et de ce fait soulève des risques de mésusage ainsi de sécurité à long terme. Par ailleurs, le mécanisme d’action exacte du méthylphénidate n’est pas encore parfaitement connu. Dans cet article de synthèse paru dans la prestigieuse revue Trends in Pharmacological Sciences, le Professeur en neuropharmacologie Luc ZIMMER, directeur du CERMEP-Imagerie du Vivant (plateforme d’imagerie préclinique et clinique sur le site du Groupement Hospitalier Est à Lyon), nous présente un état des lieux sur l’apport des données de neuro-imagerie sur le MPH.
Le MPH agit comme un dérivé amphétaminique en inhibant la recapture de la dopamine et de la noradrénaline au niveau cérébral. Ainsi, il augmente progressivement les concentrations extra-synaptiques de ces deux neuromédiateurs. Si la noradrénaline est décrite pour son rôle dans la concentration et la dopamine dans la motivation, la majorité des données ont été obtenues chez le modèle animal. L’intérêt des techniques de neuroimagerie TEP et IRM est donc d’apporter une dimension translationnelle à ces connaissances, en objectivant l’action du MPH au niveau cérébral chez le volontaire sain ou le patient.
Tout d’abord la TEP (tomographie par émission de positon) qui consiste en l’injection d’un radiopharmaceutique de courte demi-vie radioactive, émetteurs de positons et ciblant spécifiquement un récepteur ou un transporteur cérébral. Cette radioactivité, localisée sur la cible, est détectée par des caméras dédiées en médecine nucléaire, donnant lieu à la reconstruction d’une image cérébrale dite « fonctionnelle » (les contours anatomiques ne sont pas révélés mais les récepteurs/transporteurs en action).
L’imagerie TEP, selon le paradigme expérimental et le radiopharmaceutique choisis, permet de répondre à plusieurs questions pharmacologiques. Quelle est la durée d’action du MPH ? Quel est son effet neurochimique au long court ? Quels sont ses risques d’addiction ?
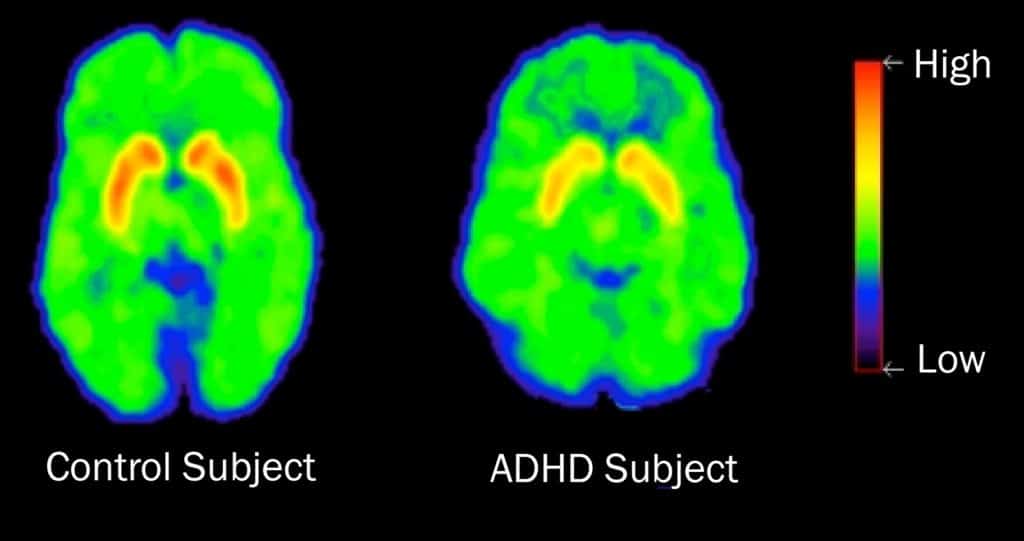
Ainsi, la comparaison d’images TEP des transporteurs de la dopamine (DAT) obtenues à des temps différents chez une même personne après administration unique de MPH à libération unique a permis de démontrer que la durée d’efficacité clinique de la molécule (environ 4h) est corrélée à son taux d’occupation sur le cible, le DAT. Cette courte durée d’occupation pose le problème d’une prise pluriquotidienne de médicament, ce qui n’est parfois pas aisé chez les enfants durant leur période scolaire. C’est pourquoi des formules à libération prolongée (L.P) ont été développées. Le même protocole d’imagerie par TEP a alors démontré une occupation prolongée du DAT durant toute la journée avec ces formes LP.
Lors d’une utilisation au long cours, plusieurs études montrent une diminution de la densité des DAT au niveau du striatum chez les patients TDAH non traités par médicament. En Imagerie par Résonnance Magnétique (IRM), les patients TDAH présentent également une diminution de l’épaisseur corticale (substance grise) de différentes régions cérébrales ainsi que des anomalies de la substance blanche. Une étude longitudinale sur 12 mois a pu montrer que le traitement par MPH permettait une ré-augmentation modérée mais significative de la densité DAT au niveau du striatum.
Cependant les études d’imagerie apportent des données contradictoires concernant la « normalisation » de l’épaisseur de la substance grise de certaines régions du cerveau chez les patients TDAH traités. C’est également le cas pour les anomalies de la substance blanche, les études ne retrouvant pas de modification significative induite par le MPH. Il est donc prématuré au vu des données actuelles, que la neuroimagerie fournisse des biomarqueurs prédictifs de la réponse au MPH.
Concernant les liens entre TDAH et addiction, que nous disent les études de neuroimagerie ? Le mécanisme pharmacologique du MPH implique une augmentation des concentrations dopaminergiques au niveau mésocorticolimbique. C’est une voie connue et commune dans les addictions, à priori défavorable pour ce médicament. La neuroimagerie TEP a cependant permis de relativiser ce risque. En effet, pour qu’une molécule soit addictive, au-delà de l’activation directe ou indirecte de la voie dopaminergique dite « du plaisir », il faut que la molécule atteigne rapidement le cerveau afin d’imprimer un effet « pulse » sur les neurones dopaminergiques. Ce mécanisme explique notamment que les voies privilégiées par les sujets consommant des toxiques sont les voies intraveineuses, intranasale ou inhalée. Ici l’utilisation de l’imagerie TEP, qui consiste à rendre radioactif le MPH puis à suivre sa biodisponibilité cérébrale sous une caméra, nous montre que l’action du MPH atteint un plateau pour diminuer progressivement là où les substances plus addictives, comme la cocaïne, ont une action modélisée par un ‘’pic’’ (action forte soudaine avec une fin rapide). Ces données sont en faveur d’un potentiel addictif plus faible du MPH. Ce constat va dans le sens des constats cliniques, car les patients prenant des doses thérapeutiques de MPH ne ressentent pas d’euphorie ou de sensations positives comme ils peuvent en retrouver avec la cocaïne.
Ainsi, sans prétendre répondre à toutes les questions pharmacologiques et thérapeutiques des effets du MPH, les données de neuroimagerie fournissent donc des éléments de compréhension du mode d’action et des risques de mésusage, en phase avec les données cliniques et de pharmacovigilance.
Par Mikail Nourredine
interne en psychiatrie, DESC de pharmacologie
Service Universitaire d’Addictologie de Lyon
Remerciements au Pr Luc Zimmer pour sa relecture attentive

