
La frontière entre cannabis récréatif et thérapeutique n’est d’ailleurs pas claire. Un article récent de la revue de toxicologie analytique et clinique se penchait d’ailleurs récemment sur le cannavaping et son statut exact : voir Varlet et al., 2016. Cannavaping: vapotage récréatif ou nouveau mode d’administration de médicaments. Revue de Toxicologie Analytique et Clinique.
Pour rappel, la plupart des pays d’Europe autorisent déjà le cannabis médical. En France, Le 25 Octobre, l’Assemblée Nationale a voté l’expérimentation du cannabis thérapeutique dans l’Hexagone. A partir du 1er semestre 2020, l’expérimentation concernera des patients souffrants de certaines formes d’épilepsie, de douleurs neuropathiques, d’effets secondaires de chimiothérapie, ou de contractions musculaires incontrôlées de scléroses en plaques, pour lesquelles les dérivés du cannabis peuvent constituer un apport thérapeutique supplémentaire.
Dans ce contexte, parmi les nombreuses questions qui se posent sur la toxicité potentielle du cannabis thérapeutique, il semble important de connaître les potentielles interactions entre les produits à base de cannabis et la thérapeutique médicamenteuse habituelle. C’était précisément la question que se posait la présente revue de littérature de Qian et al, publiée dans le Journal of Clinical Psychopharmacology, et plus précisément d’identifier la répercussion de l’utilisation du cannabis sur les enzymes et les transporteurs des médicaments.
La recherche des études pertinentes a été réalisée via Google scholar et la base de données MEDLINE (données recueillies jusque Mars 2019)
L’ensemble des articles descriptifs in vitro ou études cliniques concernant les interactions entre les médicaments et le cannabis a été inclus, mais également des articles obtenues en croisant les différentes bibliographies des premiers articles identifiés.
Après avoir comparé les paramètres de l’inhibition in vitro aux concentrations physiologiquement réalisables de cannabinoïdes, il a été conclue que les cytochromes CYP2C9, CYPA1/2 et CYP1B1 sont plus que probablement inhibées par les 3 formes majeures de cannabinoïdes, en particulier Δ9-tetrahydrocannabinol (THC), cannabidiol CBD et cannabinol CBN.
Pour rappel, les cytochromes P450 sont des enzymes essentiellement hépatiques dont certaines isoformes sont impliquées dans le métabolisme des médicaments. Environ la moitié des médicaments de la pharmacopée est éliminée entièrement ou partiellement par le métabolisme hépatique CYP-dépendant. Sont mis entre parenthèse des exemples de médicaments ou de substance métabolisés par les CYP.
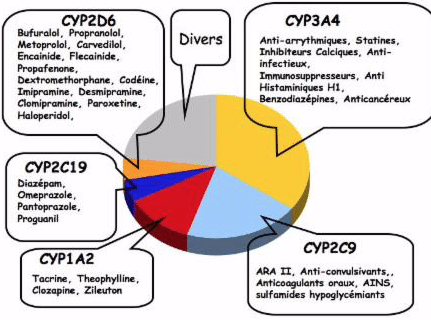
(source : pharmacogenetics.fr)°
Les isoformes CYP2D6, CYP2C19 (clopidogrel diazépam propranolol oméprazole), CYP2B6 (Bupropion,methadone, tramadol) et CYP2J2 sont inhibées par le THC et le CBD.
CYP3A4/5/7 (alprazolam, amlodipine aripiraprazole) est potentiellement inhibée par le CBD. Le THC active CYP2C9 et induit CYP1A1.
Pour les autres enzymes métabolisantes non CYP, UGT1A9 est inhibé par le CBD et le CBN tandis que UGT2B7 est inhibée par le CBD mais activé par le CBN. Carbosylesterase CES1 est potentiellement inhibé par le THC et le CBD. Des études cliniques suggèrent l’inhibition du CYP2C19 par le CBD, inhibition du CYP2C9 par des produits variés du cannabis. Et l’induction du CYP1A2 par le cannabis fumé. L’inhibition par le CBD de l’UGT et du CES1 a été mise en évidence dans quelques études, mais les données sont limitées. Ils n’ont pas identifiés d’études cliniques suggérant une influence des cannabinoïdes sur les transporteurs des médicaments; les résultats des études in vitro suggèrent qu’une interaction clinique est peu probable.
Les médicaments qui sont des substrats de premier plan pour le CYP2C19 CYP2C9 et CYP1A2 (caféine, paracétamol) peuvent potentiellement avoir leur fonctionnement altéré par le cannabis ou l’un de ses constituants. Il faut également faire attention lorsque les médicaments ou drogues co-administrés sont métabolisés par UGT ou CES1 (méthylphénidate, cocaïne héroïne), situations pour lesquelles les informations sont limitées ce qui nécessitera des investigations supplémentaires. A l’inverse, les médicaments usuels avec une inhibition ou une induction importante sur le CYP3A4 devraient altérer la disposition du CBD.
Il semble donc y avoir un effet non-négligeable du cannabis et de ses composants sur l’élimination des médicaments, ce qui peut être à l’origine d’effets secondaires ou de perte d’effets thérapeutiques dans certains cas. Il s’agit là d’un champ encore largement en friches. Mais c’est précisément aussi l’intérêt d’une réglementation autour du cannabis de pouvoir faciliter la recherche la meilleure compréhension des effets bénéfiques ou potentiellement gênants du cannabis sur la santé des individus.
Charles LESCUT

